2023年1月2日,永利yl23411官网登录林世贤课题组在Nature Structural & Molecular Biology发表了题为“Genetic code expansion reveals aminoacylated lysine ubiquitination mediated by UBE2W”的研究论文。该研究采用遗传密码扩展的化学生物学技术,首次发现了一类新型泛素化修饰——氨基酰化赖氨酸的泛素化修饰,鉴定了泛素结合酶UBE2W介导生成新型泛素化修饰的生化机制,并揭示了新型泛素化修饰加速底物蛋白和蛋白质组降解的生物学功能。
蛋白质的翻译后修饰广泛地存在于细胞中,极大地丰富了蛋白质组的多样性,并参与调控细胞的几乎所有生理过程。因此,发现并研究细胞中具有功能的新型翻译后修饰具有重要的价值和意义。然而,由于富集和检测方法的局限,新型翻译后修饰的鉴定和功能研究仍充满挑战。同时,哺乳动物细胞的泛素化修饰类型复杂且高度动态可逆,参与调控几乎所有重要生物学过程。除少数偶发在非赖氨酸残基和非蛋白质底物上的泛素化修饰外,蛋白质泛素化被认为发生在底物蛋白质的赖氨酸上。
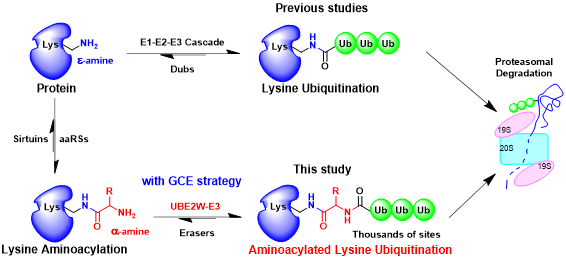
图:氨基酰化赖氨酸泛素化修饰的发生机制和生物学功能。
林世贤课题组首先合成了氨基酰化赖氨酸分子作为化学探针,并利用他们擅长的遗传密码扩展策略将氨基酰化赖氨酸修饰大量展示在蛋白质组中。结合高效液相色谱-质谱分析技术,发现了一类发生在氨基酰化赖氨酸内部α-氨基上的新型翻译后修饰——氨基酰化赖氨酸泛素化修饰(K-XUb修饰)。与此同时,该研究通过抗体富集和质谱分析的手段,在Hep2和Jurkat细胞系的1200多种底物蛋白上,鉴定到了2000多个K-XUb的修饰位点。进一步的实验表明K-XUb修饰可以促进特定底物蛋白和蛋白质组发生蛋白酶体依赖性的降解,其降解速率显著快于经典赖氨酸泛素化介导的蛋白质降解。最后,通过体外筛选和细胞验证实验,该研究发现了催化产生K-XUb修饰的特异修饰酶——UBE2W,揭示了UBE2W催化内部α-氨基形成分叉肽键的独特催化活性。
该论文提供了利用遗传密码扩展技术发现和研究新型翻译后修饰的思路和流程,首次发现了一类全新的氨基酰化赖氨酸的泛素化修饰,鉴定了赖氨酸氨基酰化修饰和泛素化修饰的相互作用规律,丰富了人们对泛素化修饰的类型、机制和功能的认识,并拓展了蛋白质翻译后修饰的研究边界。
永利yl23411官网登录博士毕业生生臧佳和陈宇霖是论文的共同第一作者,林世贤研究员是本文的通讯作者。研究工作得到了何向伟教授、宋海教授、郭行教授、杨兵教授、Vivian Yu博士,以及生命科学研究院共享技术平台的刘璐、张夏俊等的大力支持与帮助。该研究受国家重大研究计划“生物大分子动态修饰与化学干预”项目,国家重点研发计划“合成生物学”项目,和国家优青项目等项目的资助。
原文链接:https://www.nature.com/articles/s41594-022-00866-9
林世贤实验室聚焦于整合化学和生物学科的交叉研究手段,探索tRNA和蛋白质修饰的生物学功能和工程改造,并基于此开发新型生物医药,用于重大疾病和罕见遗传病的诊疗。欢迎感兴趣的博士后和研究生联系并申请加入。实验室链接:/25713/list.htm