细胞可塑性对干细胞、再生、肿瘤、衰老等领域至关重要。2023年5月16日,祝赛勇实验室在PNAS杂志在线发表题为“Harnessing endogenous transcription factors directly by small molecules for chemically induced pluripotency inception”的研究论文,筛选发现促进细胞重编程的小分子药物,并揭示了细胞命运调控新机制。
诱导多能干细胞(iPSCs)具备类似于胚胎干细胞的无限自我更新能力和多胚层分化潜能,被广泛应用于疾病建模、药物开发和再生医学。相比于转基因,化学生物学手段具有操作简便且处理可逆等优点。细胞化学重编程是近年来干细胞领域的一个重大突破;但是,细胞化学重编程仍存在效率低、分子机制不清晰等问题,严重阻碍了其应用,并限制了我们对其分子机理的深入解析。
为解决效率低和机制不清晰等问题,本研究首先通过开展化学小分子文库筛选,发现一个新的小分子CD3254通过激活内源转录因子RXRα,显著提高细胞化学重编程效率。通过一系列实验证明CD3254处理获得的化学诱导多能干细胞具备多能性,能够分化成三个胚层细胞和组织,将ciPSCs打到小鼠胚胎,能够获得健康的小鼠。进一步的机制研究揭示,CD3254-RXRα能够直接转录激活RNA外切体(RNA exosome)的所有11个基因(Exosc1-10和Dis3),而且相关功能实验也证明RNA外切体在细胞重编程过程中是必不可少。有意思的是,在重编程过程中RNA 外切体能够降解转座子相关RNAs,其中多数转座子属于MMVL30家族;进一步功能实验表明MMVL30是细胞化学重编程的一个新障碍,其敲低可以促进细胞重编程效率;重要的是,CD3254-RXRα-RNA外切体这一信号轴可以通过降解MMVL30转座子相关RNAs,减少细胞内双链RNAs的形成,减弱双链RNAs引发的细胞炎症反应(包括IFN-γ和TNF-α等通路),从而有效促进细胞重编程。
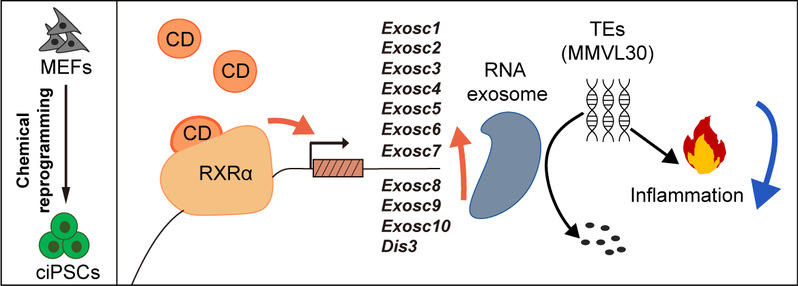
图1. CD3254-RXRα转录激活RNA外切体并调控炎症反应促进细胞化学重编程
总之,该研究为如何利用环境信号调控细胞命运决定及转换提供了新手段,有助于我们更深入理解细胞命运可塑性机理;更重要的是,机制研究揭示小分子药物CD3254可以直接激活RNA外切体,并能调控转座子RNAs介导的炎症反应,为精准操纵细胞命运提供了重要理论基础,在疾病治疗及再生医学中具有广泛应用潜力。
祝赛勇实验室2018级博士生金燕和2019级博士生陆云昆为论文的共同第一作者,祝赛勇研究员为论文的通讯作者。该课题受到了国家自然科学基金、科技部重点研发计划、浙江省自然科学基金等项目的资助。
附永利yl23411官网登录祝赛勇实验室招聘博士后
永利yl23411官网登录祝赛勇实验室长期聚焦在干细胞化学生物学、再生医学等前沿领域,相关研究成果发表在Nature、Cell Stem Cell、PNAS、Science Advances、Nature Communications、EMBO J等国际知名期刊。现根据工作需要,公开招聘博士后2-3名,详情请见:/25637/list.htm。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2215155120