TGF-β是调控细胞稳态的多功能细胞因子,它在肿瘤发生早期通过诱导细胞周期阻滞和促进细胞凋亡发挥抑癌作用。作为TGF-β信号转导的中心蛋白Smad4,其活性的丧失是肿瘤发生的关键事件,在胰腺和大肠癌中常见Smad4基因的缺失和突变。然而,非突变性Smad4活性丧失的肿瘤特异性机制尚不清楚。
2023年12月15日,冯新华实验室在Developmental Cell在线发表了题为“Smad4 sequestered in SFPQ condensates prevents TGF-β tumor-suppressive signaling”的研究论文。该研究发现一种叫做SFPQ的RNA结合蛋白直接结合Smad4,通过相分离抑制了Smad4的转录活性,从而阻断了TGF-β信号的抑瘤功能。
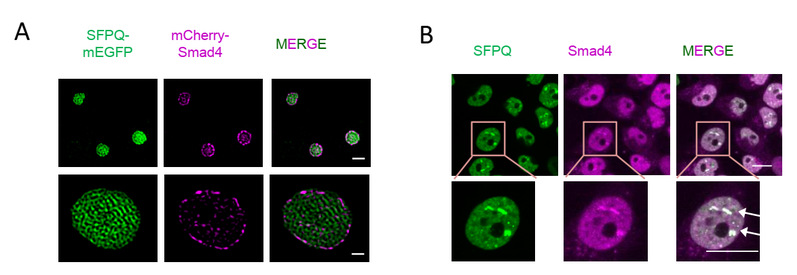
图1:SFPQ凝聚体在分子(A)和细胞(B)水平滞留抑癌蛋白Smad4。
相分离现象是近年来的热点方向,细胞内大分子可以通过相分离形成无膜结构的凝聚体,在细胞信号传导、物质输运、免疫应答等细胞功能方面扮演了重要角色。相分离不仅可以浓缩聚集细胞内的特定大分子从而加速生物化学反应,还可以在时间和空间上隔断不同的成分从而负调控反应进程。过去的工作发现SFPQ能形成RNA结合依赖的相分离。本研究发现,SFPQ对TGF-β信号的调控并不依赖于它的RNA结合能力,而是通过类朊病毒结构域(PrLD)形成液-液相分离,并通过新型的Smad结合结构域,在细胞核内将Smad4选择性地滞留在凝聚体内,导致Smad复合物的解离,破坏了Smad4的转录活性。进一步的临床数据分析显示SFPQ的高表达与多种人类癌症(如早期原发性肝细胞癌)的发生密切相关。不同的肝癌模型证实了SFPQ能够促进肿瘤形成,其促癌作用依赖于相分离活性。因此,本研究揭示了相分离在细胞信号转导的时空调控作用,提出了肿瘤细胞拮抗TGF-β生长阻滞作用的新机制,为癌症的早期诊断和靶向治疗提供新的思路。
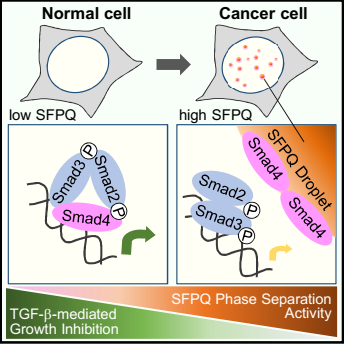
图2:SFPQ凝聚体阻断TGF-β抑制肿瘤发生的分子机制工作模型
冯新华实验室副教授肖睦、博士生王飞为本文共同第一作者。该工作获得国家自然科学基金委重点项目、重大研究计划重点支持项目、区域创新发展联合基金、科技部国家重大研究计划,浙江省自然科学基金重大项目和中央高校基本科研经费的资助。
原文链接:https://www.cell.com/developmental-cell/fulltext/S1534-5807(23)00618-4