细胞命运可塑性是一个重要的生物学前沿问题,可为干细胞治疗、在体修复、器官再造提供理论依据和方法策略。多能干细胞,包括胚胎干细胞和诱导多能干细胞,为研究细胞命运决定及转换调控提供了重要研究系统;其中,体细胞重编程和干细胞分化等方面研究极大促进了我们对细胞可塑性的理解。
细胞命运转变过程涉及到广泛的代谢重塑、染色质景观变化和基因网络调控。例如,代谢重塑可以通过代谢物对生物大分子(DNA、RNA、蛋白质)进行多种化学修饰,进而促进表观遗传重塑,共同精准调控干细胞命运。相较于DNA和组蛋白层面的表观遗传调控,RNA表观转录调控对细胞命运转换的重要性近些年才引起人们的重视,目前领域内关于转录后修饰对细胞命运的调控的研究仍比较缺乏。对于这些不同层面的调控以及它们之间串扰的研究具有重要意义,能够促进对细胞命运决定与转换的理解。
目前,关于mRNA N6-甲基腺苷(m6A)的研究相对较多;mRNA其它修饰的作用与功能也越来越受到关注,例如N4-乙酰胞苷(ac4C)修饰是近期发现的另一种mRNA修饰。毫无疑问,ac4C修饰及其对应的乙酰转移酶NAT10在干细胞命运决定与转换,尤其是在体细胞重编程和干细胞分化等过程中的作用及机制,是非常重要的科学问题,然而目前缺乏系统研究报道。
2024年1月12日,生研院祝赛勇与高分子科学与工程系刘建钊实验室合作在Science Advances发表题为N-acetyltransferase NAT10 controls cell fates via connecting mRNA cytidine acetylation to chromatin signaling的研究论文。该研究利用多能干细胞体系,系统研究了NAT10在调控干细胞命运过程中的作用,发现NAT10调控体细胞重编程和干细胞向胰腺分化等过程。然后,通过ac4C-RIP和蛋白质组学筛选,研究人员发现NAT10介导的ac4C修饰调控的靶点富集于对细胞命运具有重要导向作用的染色质调节因子,并筛选到下游功能性靶标ANP32B。NAT10能以ac4C依赖的方式调控ANP32B的表达水平,表型实验进一步揭示NAT10-ac4C-ANP32B轴对细胞命运转换非常重要。接着,结合多组学联合分析,研究人员发现ANP32B部分介导了NAT10对组蛋白二价修饰(H3K4me3、H3K27me3)、染色质可及性等染色质景观的动态调控,影响了对细胞命运决定至关重要的信号通路(包括Wnt、TGFβ)的关键调节因子(如SFRP1、NODAL)的组蛋白修饰二价性和基因表达,进而精准调控干细胞命运。
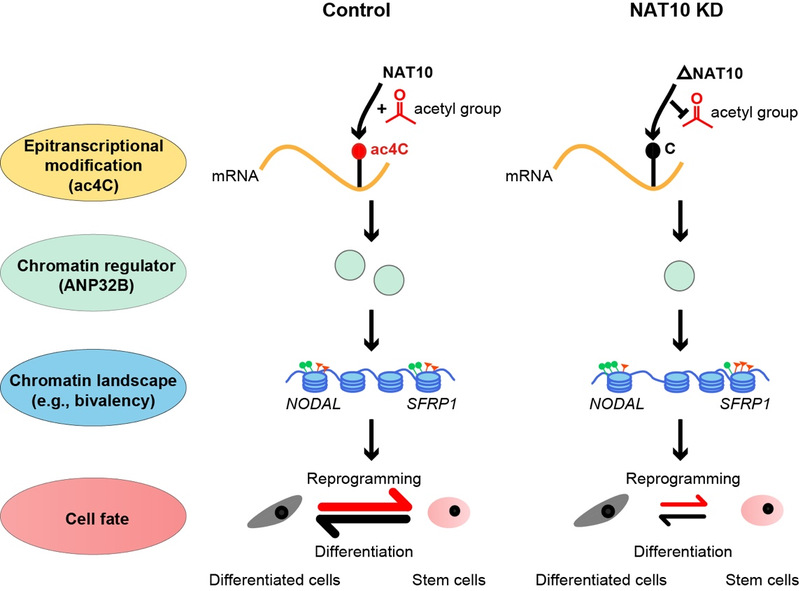
图1. NAT10-mRNA ac4C对干细胞命运的重要调控作用及分子机制
综上所述,该研究通过系统研究发现NAT10对干细胞命运(包括体细胞重编程和干细胞向胰岛分化)具有重要调控功能;多方面证明NAT10所催化的mRNA ac4C是一个重要的表观转录调控修饰;通过多组学整合分析发现NAT10-ac4C-ANP32B介导了表观转录和表观遗传间的重要关联。总之,这些研究为细胞可塑性及其调控机制提供了新思路和新见解,不仅对发育、肿瘤、免疫、衰老等学科具有借鉴意义,而且有望推动干细胞生物学和再生医学的发展及应用。
生研院祝赛勇研究员和高分子科学与工程系刘建钊教授为论文的共同通讯作者,祝赛勇实验室博士生胡振升、陆云昆,刘建钊实验室博士后曹婕为论文的共同第一作者。该研究受到了国家自然科学基金、科技部重点研发计划、浙江省杰出青年基金等项目资助。
附永利yl23411官网登录祝赛勇实验室招聘博士后
永利yl23411官网登录祝赛勇实验室长期聚焦干细胞生物学与再生医学等前沿领域,相关研究成果发表在Nature、Nature Cell Biology、Cell Stem Cell、Science Advances、Nature Communications、EMBO J、PNAS等国际知名期刊。现根据工作需要,公开招聘博士后2-3名,详情请见:/25637/list.htm。
原文链接:https://www.science.org/doi/10.1126/sciadv.adh9871